Movimiento de subducción de las placas téctonicas situadas próximás a Japón (corteza oceánica) –> Tsunamis de enormes magnitudes –> rotura de reactores nucleares –> pánico nuclear + miles de muertos y desaparecidos, Japón, tercera potencia económica mundial sufre unas pérdidas humanas y económicas sin precedentes…
Debido a esto he decidido retomar mis apuntes de física nuclear y geología para explicar de la manera más fácil en qué consiste la radioactividad así cómo los movimientos terrestres.
Para explicar la radioactividad es necesario definir lo que es un átomo. Si cogemos la tabla periódica de los elementos nos encontramos con los elementos químicos presentes en la tierra, todos ellos son átomos (la unidad más pequeña del elemento químico y no presentan carga). Si un átomo se une a otro(s) tenemos una molécula. Si un átomo pierde o gana un electrón, tenemos el mismo elemento químico pero con carga, llamado ión. Si un átomo se divide en el seno de su núcleo, da lugar a otros átomos o elementos químicos diferentes. Nosotros estamos compuestos principalmente por agua (H2O), lo que hace que los elemenos químicos más presentes en el cuerpo humano sean el hidrógeno (H) y el oxígeno (O).
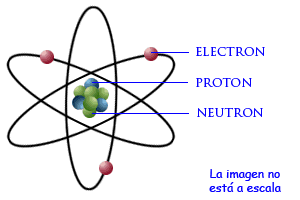
El átomo se compone de su núcleo + electrones (carga negativa) que orbitan alrededor del núcleo. El núcleo del átomo presenta protones
(partículas cargadas positivamente) y neutrones (partículas neutras). Debido a que el átomo no presenta carga, esto implica que el número de protones sea igual al número de electrones.Lo que diferencia un elemento químico de otro es básicamente su número atómico Z (su número de protones en el núcleo). La figura lo explica perfectamente, las líneas negras son los movimientos orbitales de los electrones alrededor del núcleo.
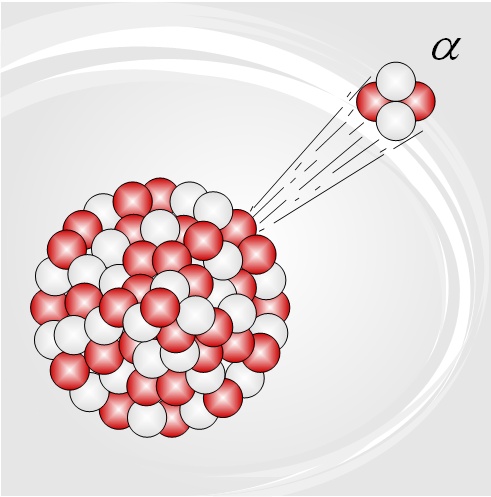
Ahora bien, qué es un isótopo? La mayoría de los elementos químicos poseen isótopos, algunos estables y otros inestables. Los isótopos son átomos del mismo elemento pero que varian en su masa ya que poseen más o menos neutrones en su núcleo. Por ejemplo, el Carbono (C) más abundante es el C12 (12= 6 protones + 6 neutrones en núcleo), pero también existe el isótopo C13 (6 protones + 7 neutrones) y el C14 (6 protones + 8 neutrons). El C14 es el isótopo inestable y que, de manera natural se desintegra poco a poco, lo que hace que sea un isótopo radioactivo. Esta desintegración emite radioactividad bajo emisiones alpha, beta o gamma. La emisión gamma es la más ionizante y con mayor poder de penetrabilidad, pero la que nos interesa es la alpha (que es la que ocurre en los reactores nucleares).
La emisión alpha no es más que un núcleo de Helio, formado por dos protones y dos neutrones y por lo tanto con dos cargas postivias (ion He 2+). Resumiendo, un átomo X dará lugar a un átomo Y de menor masa con emisión de He 2+: X–> Y + He 2+.
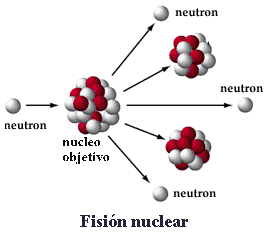
En los reactores nucleares se trabaja con Uranio y dos de sus isótopos el U238 (92 protones+ 146 neutrones) y U235 (92 protones+143 neutrones). Lo que ocurre realmente es una reaccción en cadena de fisión, dónde una partícula iniciadora choca con el núcleo de Uranio, éste se divide, formando otros elementos químicos y emitiendo otras partículas que a su vez chocan con más núcleos. Todo este proceso de
emisión y choque de partículas libera una cantidad de energía enorme, en forma de calor, lo que genera vapor de agua, que pasa a una turbina donde es transformado en energía eléctrica. Un pequeño detalle, dentro de un reactor nuclear, este proceso está controlado, sin embargo, la reacción en cadena sin control es lo que causa la explosión en las bomba atómicas…
¿Cuáles son los principales problemas de la energía nuclear?
La gran ventaja con respecto a las petrolíferas es que no producen gases contaminantes a gran escala, pero la principal desventaja es la gran seguridad que deben de tener debido a la radioactividad, así como el tratamineto de sus residuos.
Si una central nuclear falla en su seguridad, la contaminación por radiación es muy peligrosa. Lo peligroso no son las partículas alpha, ya que éstas no tienen poder de penetrabilidad y se desactivan en seguida al chocar con otras partículas del aire. Lo peligroso es el uranio en sí (ya que en los reactores los isótopos de uranio están a elevadas concentraciones) y los descendientes radioactivos que se forman tras el proceso de fisión (como el gas Radón). La inhalación del polvo de uranio hace que pase al torrente sanguíneo y se acumule en nuestros tejidos (hígado, riñon, aparato reproductor), provocand0 así intoxicación por metal. Además, el U235 tiene un tiempo de vida media de 4510 millones de años, es decir que pasados 4510 millones de años, la cantidad de U235 se habrá reducido a la mitad…Esto hace que la bioacumulación de Uranio sea de por vida y a la larga se convierta en un agente mutágeno, capaz de provocar mutaciones celulares y por lo tanto generación de tumores…
Los residuos de las centrales nucleares, siguen emitiendo radioactividad durante una media de 30 años, lo que hace que deban almacenarse bajo tierra en almacenes específicos.
¿Para qué sirven los isótopos radioactivos?
Los isótopos radioactivos se encuentran en la naturaleza a muy bajas concentraciones. Es necesario extraerlos de ciertos minerales y concentralos. Como ya hemos visto su uso puede ir destinado a la generación de energía elétrica o armas nucleares, pero también tiene usos a menor escala:
-Debido a la elevada vida media, se utilizan para dataciones geológicas. Por ejemplo, cuando se encuentra un fósil, como éste presenta Carbono 14 (con una vida media de 5730 años) se puede utilizar para datarlo en el tiempo.
-Aplicaciones médicas: para diagnosticar o tratar enfermedades (rayos X, gammagrafías…)
En la siguiente parte trataré la tectónica de placas así como los cambios cíclicos que sufre la tierra desde su formación.
Mientras tanto…